KUALA LUMPUR – Pihak Berkuasa Kawalan Dadah (PBKD) Kementerian Ksihatan bersetuju untuk membatalkan pendaftaran dan mengeluarkan arahan panggil balik ke atas semua produk berdaftar yang mengandungi pholcodine.
Ia berikutan terdapatnya risiko keselamatan terjadinya anafilaksis (reaksi alahan teruk yang boleh mengancam nyawa) dengan penggunaan ubat pengendur otot atau neuromuscular blocking agents (NMBAs) semasa proses pembiusan umum (general anaesthesia), terutamanya kepada mereka yang pernah mengambil ubat yang mengandungi pholcodine dalam tempoh 12 bulan lalu.
“Dengan erti kata lain, mereka yang mengambil ubat yang mengandungi pholcodine (kebiasaannya ubat batuk) dalam tempoh 12 bulan lalu berhadapan risiko yang lebih tinggi untuk mengalami anafilaksis sekiranya diberi ubat pengendur otot atau neuromuscular blocking agents (NMBAs) semasa proses pembiusan penuh (general anaesthesia), misalnya semasa menjalani pembedahan,” kata Ketua Pengarah KKM, Tan Sri Dr Noor Hisham Abdullah.
Pholcodine adalah sejenis ubat bagi mengawal dan menghentikan batuk jenis kering (nonproductive/dry, irritating) dalam kalangan dewasa dan kanak-kanak.
Di Malaysia, pholcodine diklasifikasikan sebagai ubat terkawal Kumpulan C dan boleh diperolehi tanpa preskripsi.
Terdapat sejumlah 14 produk mengandungi pholcodine yang berdaftar dengan PBKD dalam bentuk tunggal dan kombinasi dengan ubat lain.
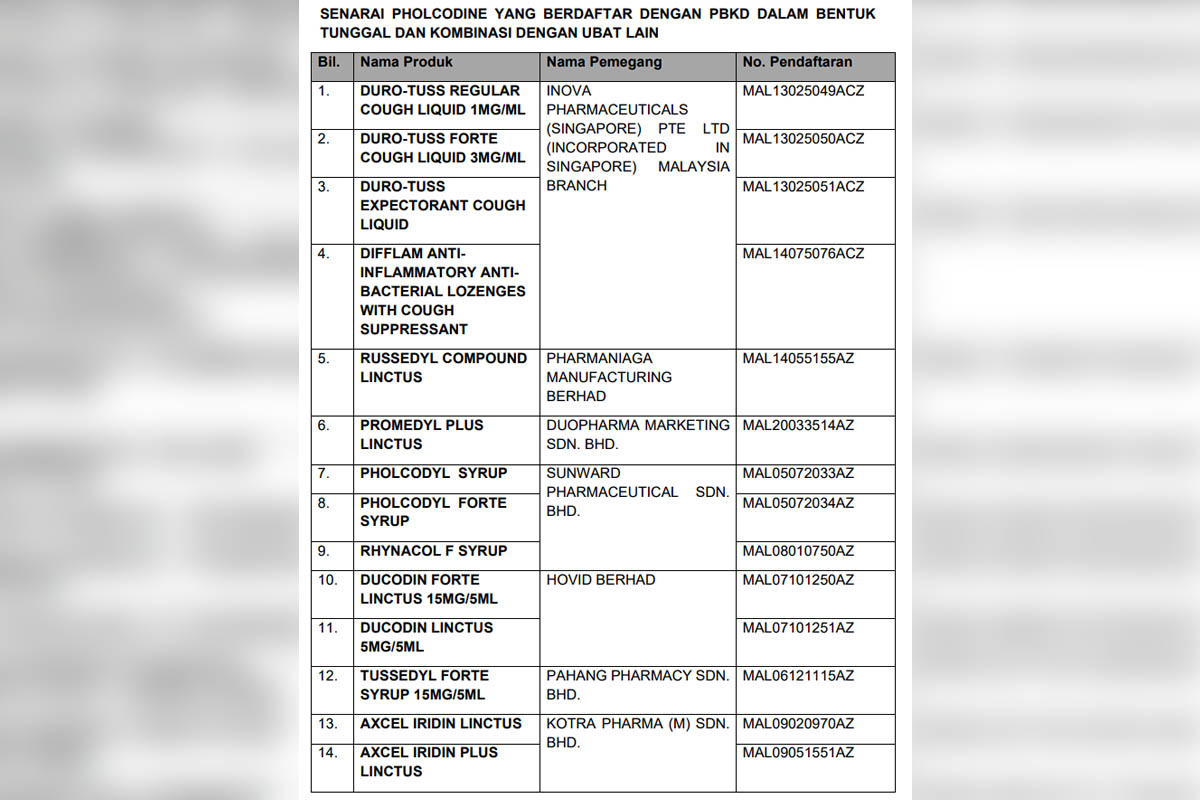
Setakat ini, Pusat Pemonitoran Kesan Advers Ubat Kebangsaan, Bahagian Regulatori Farmasi Negara (NPRA) telah menerima sejumlah 12 laporan dengan 17 kesan advers susulan penggunaan pholcodine.
Namun begitu, daripada laporan tersebut, tiada laporan anaphylaxis yang diterima, tambah Noor Hisham.
Walaupun tiada laporan kesan advers diterima oleh NPRA setakat ini, keputusan PBKD ini diambil berdasarkan bukti-bukti daripada kajian “Allergy to Neuromuscular Blocking Agents and Pholcodine Exposure” (ALPHO), data keselamatan pasca pemasaran dan maklumat yang diperoleh daripada pengamal perubatan, agensi negara-negara lain seperti United Kingdom, Australia, beberapa negara Kesatuan Eropah seperti Perancis dan Norway yang mana telah mengambil tindakan regulatori bagi pembatalan dan panggil balik produk yang mengandungi pholcodine.
Selain itu, Pertubuhan Bangsa-Bangsa Bersatu juga turut melaporkan sejumlah 852 laporan kesan advers yang melibatkan penggunaan pholcodine. Daripada jumlah tersebut, terdapat 42 laporan anaphylactic reaction dan 20 laporan anaphylactic shock yang dilaporkan. Daripada kes tersebut, terdapat 9 kes yang melibatkan penggunaan bersama NMBA (suxamethonium).
Berdasarkan penilaian risiko yang teliti didapati tiada langkah pengurangan risiko yang dapat diambil bagi meminimumkan risiko ini buat pengguna.
Justeru, didapati risiko pengambilan ubat pholcodine didapati telah melebihi manfaatnya.
“Sehubungan itu, PBKD telah bersetuju untuk membatalkan pendaftaran semua produk yang mengandungi pholcodine dan menjalankan prosedur panggil balik,” katanya dalam kenyataan di sini.
Dr Noor Hisham berkata, terdapat ubatan alternatif yang boleh digunakan bagi indikasi batuk jenis kering (nonproductive/dry, irritating) seperti produk yang mengandungi dextromethorphan.
Sehingga kini, terdapat lebih daripada 40 produk mengandungi dextromethorphan dalam bentuk tunggal dan kombinasi dengan ubat lain yang berdaftar dengan PBKD.
Susulan pembatalan pendaftaran produk mengandungi pholcodine, semua syarikat Pemegang Pendaftaran Produk bertanggungjawab untuk memaklumkan kepada farmasi komuniti dan klinik-klinik yang telah dibekalkan dengan produk tersebut untuk berhenti menjual dan memastikan produk dikuarantin sebelum dipulangkan semula kepada pembekal.
Anggota kesihatan juga diingatkan untuk berhenti memperskripsi, mendispens, menjual atau mengedar semua produk mengandungi pholcodine dengan serta-merta. Pesakit yang mengalami batuk jenis
nonproductive hendaklah diberikan ubat alternatif.
Semua baki stok produk yang mengandungi pholcodine perlu dikuarantin dan dipulangkan semula kepada pembekal.
Orang awam yang sedang mengambil ubat batuk dan selsema diingatkan untuk menyemak label atau sisip bungkusan produk, sama ada terdapat bahan aktif pholcodine. Jika didapati ubatan tersebut mengandungi bahan aktif pholcodine, hentikan pengambilan dan rujuk kepada anggota kesihatan bagi mendapatkan rawatan alternatif.
Bagi mereka yang perlu menjalani pembedahan dan memerlukan bius sepenuhnya, maklumkan kepada anggota kesihatan sekiranya anda pernah mengambil ubat yang
mengandungi pholcodine terutamanya dalam tempoh 12 bulan lalu. – MalaysiaGazette

















